Cyfansoddyn cemegol
Mae cyfansoddyn cemegol yn sylwedd sy'n cynnwys llawer o foleciwlau unfath (neu endidau moleciwlaidd) sy'n cynnwys atomau o fwy nag un elfen sy'n cael eu dal at ei gilydd gan fondiau cemegol. Felly, nid yw moleciwl sy'n cynnwys atomau o un elfen yn unig yn gyfansoddyn.
| Enghraifft o'r canlynol | grwp neu ddosbarth o sylweddau cemegol, meta-ddosbarth o'r radd flaenaf |
|---|---|
| Math | sylwedd pur, cydran gemegol |
| Yn cynnwys | atom, bondio cemegol |
Ceir pedwar math o gyfansoddion, yn dibynnu ar sut mae'r atomau'n cael eu dal gyda'i gilydd:
- moleciwlau sy'n cael eu dal at ei gilydd gan fondiau cofalent
- cyfansoddion ïonig sy'n cael eu dal at ei gilydd gan fondiau ïonig
- cyfansoddion rhyngfetalaidd sy'n cael eu dal at ei gilydd gan fondiau metalaidd
- rhai cymhlygion (complexes) sy'n cael eu dal at ei gilydd gan fondiau cofalent cyfesurynnol .
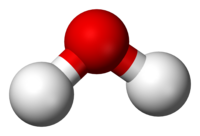
Mae fformiwla gemegol yn pennu nifer yr atomau o bob elfen mewn moleciwl cyfansawdd, gan ddefnyddio'r talfyriadau safonol ar gyfer yr elfennau cemegol a thanysgrifiadau rhifiadol. Er enghraifft, mae gan foleciwl dŵr fformiwla H 2 O sy'n nodi dau atom hydrogen wedi'u bondio i un atom o ocsigen. Mae gan lawer o gyfansoddion cemegol ddynodwr rhif CAS unigryw wedi'i neilltuo gan y Chemical Abstracts Service. Yn fyd-eang, mae mwy na 350,000 o gyfansoddion cemegol (gan gynnwys cymysgeddau o gemegau) wedi'u cofrestru i'w cynhyrchu a'u defnyddio.[1]
Gellir trosi cyfansoddyn i sylwedd cemegol gwahanol trwy ryngweithio ag ail sylwedd trwy adwaith cemegol. Yn y broses hon, gall bondiau rhwng atomau gael eu torri yn y naill neu'r llall neu'r ddau o'r sylweddau sy'n rhyngweithio, a gall bondiau newydd ffurfio.
Diffiniadau golygu
Gall unrhyw sylwedd sy'n cynnwys dau neu fwy o wahanol fathau o atomau (elfennau cemegol) mewn cyfrannedd stoichiometrig sefydlog gael ei alw'n gyfansoddyn cemegol; deellir y cysyniad drwy ystyried sylweddau cemegol pur.[2] [3][4] Gan eu bod yn cynnwys cyfrannau sefydlog o ddau fath neu fwy o atomau fe all cyfansoddion cemegol gael eu trosi, trwy adwaith cemegol, yn gyfansoddion neu'n sylweddau, gyda phob un yn cynnwys llai o atomau.[5] Mynegir cymhareb pob elfen yn y cyfansoddyn mewn cymhareb yn ei fformiwla gemegol.[6] Mae fformiwla gemegol yn ffordd o fynegi gwybodaeth am y cyfrannau o atomau sy'n ffurfio cyfansoddyn cemegol penodol, gan ddefnyddio'r talfyriadau safonol ar gyfer yr elfennau cemegol, ac is-sgriptiau i nodi nifer yr atomau dan sylw. Er enghraifft, mae dŵr yn cynnwys dau atom hydrogen wedi'u bondio i un atom o ocsigen: y fformiwla gemegol, felly, yw H2O. Yn achos cyfansoddion sydd ddim yn stoichiometrig, gall y cyfrannau fod yn atgynhyrchadwy o ran eu paratoi, a rhoi cyfrannau sefydlog o'u helfennau cyfansoddol, ond cyfrannau nad ydynt yn annatod [ee, ar gyfer palladium hydride, PdHx (0.02 < x < 0.58 )].[7]
Mae gan gyfansoddion cemegol adeiledd cemegol unigryw a diffiniedig sy'n cael ei ddal at ei gilydd mewn trefniant gofodol diffiniedig gan fondiau cemegol. Gall cyfansoddion cemegol fod yn gyfansoddion moleciwlaidd sy'n cael eu dal at ei gilydd gan fondiau cofalent, halwynau sy'n cael eu dal at ei gilydd gan fondiau ïonig, cyfansoddion rhyngfetalaidd sy'n cael eu dal at ei gilydd gan fondiau metalaidd, neu'r is-set o gymhlygion cemegol sy'n cael eu dal gyda'i gilydd gan fondiau cofalent cyfesurynnol.[8] Yn gyffredinol, nid yw elfennau cemegol pur yn cael eu hystyried yn gyfansoddion cemegol, gan fethu'r gofyniad o ddau atom neu fwy, er eu bod yn aml yn cynnwys moleciwlau sy'n cynnwys atomau lluosog (fel yn y moleciwl diatomig H2, neu'r moleciwl polyatomig S8, ac ati.) [8] Mae gan lawer o gyfansoddion cemegol ddynodwyr rhifiadol unigryw a neilltuwyd gan y Chemical Abstracts Service (CAS): sef ei rif CAS.
Mae gwahaniaethau anghyyson mewn enwi sylweddau, sy'n cynnwys enghreifftiau gwirioneddol anstoichiometrig, o gyfansoddion cemegol, sy'n gofyn am gymarebau sefydlog. Mae llawer o sylweddau cemegol solat - er enghraifft llawer o fwynau silicad - yn sylweddau cemegol, ond nid oes ganddynt fformiwlâu syml sy'n adlewyrchu bondio elfennau â'i gilydd yn gemegol mewn cymarebau sefydlog; er hynny, mae'r sylweddau crisialog hyn yn aml yn cael eu galw'n "gyfansoddion anstoichiometrig". Gall fod gan rai cyfansoddion yr ystyrir eu bod yn union yr un fath yn gemegol symiau amrywiol o isotopau trwm neu ysgafn o'r elfennau cyfansoddol, sy'n newid cymhareb yr elfennau fesul màs, rhyw ychydig.
Mathau golygu
Moleciwlau golygu
Mae moleciwl yn grŵp niwtral (hy niwtral yn drydanol) o ddau atom neu fwy sy'n cael eu dal at ei gilydd gan fondiau cemegol.[9][10][11][12] Gall moleciwl fod yn homoniwclear, hynny yw, yn cynnwys atomau o un elfen gemegol, fel gyda dau atom yn y moleciwl ocsigen (O2); neu gall fod yn heteroniwclear, cyfansoddyn cemegol sy'n cynnwys mwy nag un elfen, fel gyda dŵr (dau atom o hydrogen ac un atom o ocsigen; H2O).
Cyfansoddion ïonig golygu
Cyfansoddyn cemegol yw cyfansoddyn ïonig sy'n cynnwys ïonau sy'n cael eu dal at ei gilydd gan rymoedd electrostatig a elwir yn fondio ïonig. Mae'r cyfansoddyn yn niwtral yn gyffredinol, ond mae'n cynnwys ïonau â gwefr bositif o'r enw catïonau ac ïonau â gwefr negatif o'r enw anionau. Gall y rhain fod yn ïonau syml fel y sodiwm (Na+) a’r clorid (Cl−) mewn sodiwm clorid, neu rywogaethau polyatomig fel yr amoniwm (NH+4) ac ïonau carbonad (CO2−3) mewn amoniwm carbonad. Mae gan ïonau unigol o fewn cyfansoddyn ïonig gymdogion agosaf lluosog fel arfer, felly nid ydynt yn cael eu hystyried yn rhan o foleciwlau, ond yn hytrach yn rhan o rwydwaith tri dimensiwn di-dor, fel arfer mewn adeiledd crisialog.
Cyfansoddion rhyngfetalaidd golygu
Math o aloi metelaidd yw cyfansoddyn rhyngfetalaidd sy'n ffurfio cyfansoddyn cyflwr solet trefnedig rhwng dwy neu fwy o elfennau metelaidd. Yn gyffredinol, mae rhyngfetalau'n galed ac yn frau, gyda phriodweddau mecanyddol tymheredd uchel da.[13][14][15] Gellir eu dosbarthu fel cyfansoddion rhyngfetalaidd stoichiometrig neu anstoichiometig.[13]
Bondio a grymoedd golygu
Mae cyfansoddion yn cael eu dal gyda'i gilydd trwy amrywiaeth o wahanol fathau o fondio a grymoedd. Mae'r gwahaniaethau yn y mathau o fondiau mewn cyfansoddion yn amrywio yn seiliedig ar y mathau o elfennau sy'n bresennol yn y cyfansoddyn.
Mae bond cofalent, a elwir hefyd yn fond moleciwlaidd, yn golygu rhannu electronau rhwng dau atom. Yn bennaf, mae'r math hwn o fond yn digwydd rhwng elfennau sy'n disgyn yn agos at ei gilydd ar y tabl cyfnodol o elfennau, ond fe'i gwelir rhwng rhai metelau aac anfetalau. Mae hyn oherwydd mecanwaith y math hwn o fond. Mae elfennau sy'n disgyn yn agos at ei gilydd ar y tabl cyfnodol yn dueddol o fod ag electronegatifedd tebyg, sy'n golygu bod ganddynt affinedd tebyg ar gyfer electronau. Gan nad oes gan y naill elfen na'r llall affinedd cryfach i'w roi neu i ennill electronau, mae'n achosi'r elfennau i rannu electronau, felly mae gan y ddwy elfen wythawd mwy sefydlog.
Mae bondio ïonig yn digwydd pan fydd electronau falens yn cael eu trosglwyddo'n gyfan gwbl rhwng elfennau. Gyferbyn â bondio cofalent, mae'r bond cemegol hwn yn creu dau ïon â gwefr gyferbyniol. Mae'r metalau mewn bondio ïonig fel arfer yn colli eu electronau falens, gan ddod yn gation â gwefr bositif. Bydd yr anfetal yn ennill yr electronau o'r metal, gan wneud yr anfetal yn anion â gwefr negatif. Fel yr amlinellwyd, mae bondiau ïonig yn digwydd rhwng rhoddwr electron, fel arfer metal, a derbynnydd electronau, sy'n dueddol o fod yn anfetal. [16]
Mae bondio hydrogen yn digwydd pan fydd atom hydrogen sydd wedi'i fondio i atom electronegatif yn ffurfio cysylltiad electrostatig ag atom electronegatif arall trwy deupolau neu wefrau sy'n rhyngweithio.[17][18][19]
Adweithiau golygu
Gellir trosi cyfansoddyn i gyfansoddiad cemegol gwahanol trwy ryngweithio ag ail gyfansoddyn cemegol trwy adwaith cemegol. Yn y broses hon, mae bondiau rhwng atomau'n cael eu torri yn y ddau gyfansoddion sy'n rhyngweithio, ac yna mae bondiau'n cael eu hailffurfio fel bod cysylltiadau newydd yn cael eu gwneud rhwng atomau. Yn sgematig, gellid disgrifio'r adwaith hwn fel AB + CD → AD + CB, lle mae A, B, C, a D i gyd yn atomau unigryw; ac AB, AD, CD, a CB yn gyfansoddion unigryw.
Darllen pellach golygu
- Robert Siegfried (2002), From elements to atoms: a history of chemical composition, American Philosophical Society, ISBN 978-0-87169-924-4
Gweler hefyd golygu
Cyfeiriadau golygu
- ↑ Wang, Zhanyun; Walker, Glen W.; Muir, Derek C. G.; Nagatani-Yoshida, Kakuko (2020-01-22). "Toward a Global Understanding of Chemical Pollution: A First Comprehensive Analysis of National and Regional Chemical Inventories". Environmental Science & Technology 54 (5): 2575–2584. Bibcode 2020EnST...54.2575W. doi:10.1021/acs.est.9b06379. PMID 31968937.
- ↑ Whitten, Kenneth W.; Davis, Raymond E.; Peck, M. Larry (2000), General Chemistry (6th ed.), Fort Worth, TX: Saunders College Publishing/Harcourt College Publishers, ISBN 978-0-03-072373-5
- ↑ Brown, Theodore L.; LeMay, H. Eugene; Bursten, Bruce E.; Murphy, Catherine J.; Woodward, Patrick (2013), Chemistry: The Central Science (3rd ed.), Frenchs Forest, NSW: Pearson/Prentice Hall, pp. 5–6, ISBN 9781442559462, https://books.google.com/books?id=zSziBAAAQBAJ&pg=PA6, adalwyd 2020-12-08
- ↑ Hill, John W.; Petrucci, Ralph H.; McCreary, Terry W.; Perry, Scott S. (2005), General Chemistry (4th ed.), Upper Saddle River, NJ: Pearson/Prentice Hall, p. 6, ISBN 978-0-13-140283-6, http://www.pearsonhighered.com/educator/academic/product/0,3110,0131402838,00.html
- ↑ Wilbraham, Antony; Matta, Michael; Staley, Dennis; Waterman, Edward (2002), Chemistry (1st ed.), Upper Saddle River, NJ: Pearson/Prentice Hall, p. 36, ISBN 978-0-13-251210-7, https://archive.org/details/prenticehallchem0000wilb/page/36
- ↑ "Chemical compound". ScienceDaily (yn Saesneg). Archifwyd o'r gwreiddiol ar 2017-09-13. Cyrchwyd 2017-09-13.
- ↑ Manchester, F. D.; San-Martin, A.; Pitre, J. M. (1994). "The H-Pd (hydrogen-palladium) System". Journal of Phase Equilibria 15: 62–83. doi:10.1007/BF02667685. Phase diagram for Palladium-Hydrogen System
- ↑ 8.0 8.1 Atkins, Peter; Jones, Loretta (2004). Chemical Principles: The Quest for Insight. W.H. Freeman. ISBN 978-0-7167-5701-6.
- ↑ Ebbin, Darrell D. (1990). General Chemistry (arg. 3rd). Boston: Houghton Mifflin Co. ISBN 978-0-395-43302-7.
- ↑ Brown, T.L.; Kenneth C. Kemp; Theodore L. Brown; Harold Eugene LeMay; Bruce Edward Bursten (2003). Chemistry – the Central Science (arg. 9th). New Jersey: Prentice Hall. ISBN 978-0-13-066997-1.
- ↑ Chang, Raymond (1998). Chemistry (arg. 6th). New York: McGraw Hill. ISBN 978-0-07-115221-1.
- ↑ Zumdahl, Steven S. (1997). Chemistry (arg. 4th). Boston: Houghton Mifflin. ISBN 978-0-669-41794-4.
- ↑ 13.0 13.1 Askeland, Donald R.; Wright, Wendelin J. (January 2015). "11-2 Intermetallic Compounds". The science and engineering of materials (arg. Seventh). Boston, MA. tt. 387–389. ISBN 978-1-305-07676-1. OCLC 903959750. Cyrchwyd 2020-11-10.
- ↑ Panel On Intermetallic Alloy Development, Commission On Engineering And Technical Systems (1997). Intermetallic alloy development : a program evaluation. National Academies Press. t. 10. ISBN 0-309-52438-5. OCLC 906692179. Cyrchwyd 2020-11-10.
- ↑ Soboyejo, W. O. (2003). "1.4.3 Intermetallics". Mechanical properties of engineered materials. Marcel Dekker. ISBN 0-8247-8900-8. OCLC 300921090. Cyrchwyd 2020-11-10.
- ↑ "Ionic and Covalent Bonds". Chemistry LibreTexts (yn Saesneg). 2013-10-02. Archifwyd o'r gwreiddiol ar 2017-09-13. Cyrchwyd 2017-09-13.
- ↑ "Hydrogen Bonds". chemistry.elmhurst.edu. Archifwyd o'r gwreiddiol ar 2016-11-19. Cyrchwyd 2017-10-28.
- ↑ "Hydrogen Bonding". www.chem.purdue.edu. Archifwyd o'r gwreiddiol ar 2011-08-08. Cyrchwyd 2017-10-28.
- ↑ "intermolecular bonding – hydrogen bonds". www.chemguide.co.uk. Archifwyd o'r gwreiddiol ar 2016-12-19. Cyrchwyd 2017-10-28.