Geometrig moleciwlar
Mae cyfeiriadau bondiau cofalent yn amrywio. Er bod yna miliynau o gyfansoddion sy'n bondio'n gofalent ar gael, ond ychydig siapau sydd ar gael.
Mae'r siapau yma yn dibynnu ar y nifer o electronau allanol sydd wedi pario, gelwir y parau sy'n bondio'n gofalent yn parau bondio. Mae'r parau bondio yma yn rhoi siapau gwahanol i'r moleciwl oherwydd mae'r parau yn gwrthyrru ei gilydd. Os oes electronau ar ôl heb ei fondio, gelwir y rhain yn parau unig. Mae parau unig yn gwrthyrru yn fwy na pharau bondio.
Mae'r ddelwedd isod yn dangos y siapau a'r onglau gwahanol foleciwlau.

| Siâp | Llinol | Trigonol | Tetrahedrol | Deubyramid Trigonol | Octahedrol |
|---|---|---|---|---|---|
| Onglau | 180° | 120° | 109.5° | 90° 120° | 90° 90° |
| Nifer o electronau allanol | 4 | 6 | 8 | 10 | 12 |
| Nifer o barau o electronau | 2 | 3 | 4 | 5 | 6 |
| Esiamplau | BeF2 | BF3 | CH4, NH4+ | PCl5 | SF6 |
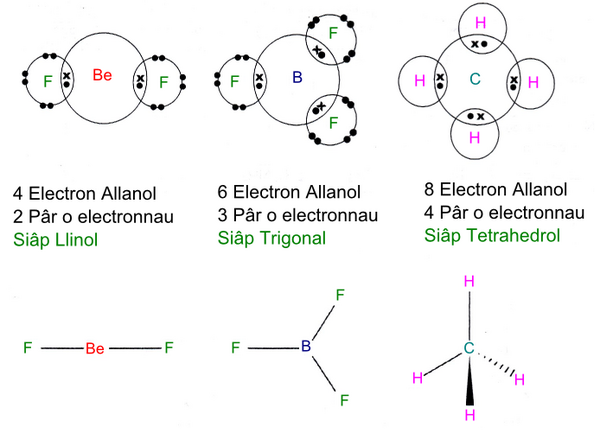
Mae'r ddelwedd isod yn dangos esiamplau o rhai siapau a'r onglau gwahanol foleciwlau- Beryliwm fflworid, Boron Trifflworid a Methan.
Mae'r gwahanol fathau o barau (parau bondio a pharau unig) yn gwrthyrru ei gilydd ar gryfderau gwahanol. Dyma'r drefn yn ôl gwrthyriad (cryfaf yn gyntaf):
- Par unig- Par unig
- Par unig- Par bondio
- Par bondio- Par bondio
Pan mae moleciwl yn cynnwys par unig mae'n lleihau ongl rhwng y bondiau gan 2.5°.
Mae'r ddelwedd isod yn dangos effaith par unig ar y siapau a'r onglau gwahanol. Amonia a Dŵr yw'r enghreifftiau.

Mae ongl yr NH3 wedi mynd o 109.5° i 107°(1 par unig)
Mae ongl yr H2O wedi mynd o 109.5° i 104.5° (2 par unig)